Inhalt
|
Was ist nitrosativer Stress?
Während die Begriffe „freie Radikale“ und „oxidativer Stress“ mittlerweile sehr verbreitet sind, und Antioxidantien sich großer Beliebtheit erfreuen, ist Nitrosativer Stress bisher erstaunlicherweise noch recht unbekannt – obwohl ihm gesundheitlich fast die gleiche Bedeutung zukommt.
Auch Nitrosativer Stress ist eine Form von oxidativem Stress, jedoch sind es hier nicht Sauerstoff-Radikale, die den Organismus belasten, sondern eine überschießende Produktion von Stickstoffmonoxid-Radikalen (chemisch: NO). Durch das Überangebot von NO-Radikalen und die vermehrte Bildung von gefährlichen Folgeprodukten wie dem hochgiftige Peroxinitrit können Zellen, Membranen und DNA geschädigt werden und eine ganze Reihe von Krankheiten und Symptomen entstehen. (1, 2)
Vitamin B12, besonders in der Form Hydroxocobalamin ist der natürliche Gegenspieler des NO und macht es unschädlich: Vitamin B12 ist ein sehr effektiver NO-Fänger und wird erfolgreich eingesetzt, um nitrosativen Stress zu bekämpfen. (3, 4)
Das ist wichtig
|
NO-Radikale: Freund oder Feind?
Wie so oft macht auch beim nitrosativen Stress erst die Dosis das Gift: Stickstoffmonoxid ist eigentlich ein wichtiger körpereigener Stoff, der zahlreiche biologische Funktionen erfüllt. NO entspannt die Gefäße, senkt den Blutdruck, ist Teil der körpereigenen Immunabwehr und wirkt sogar als Botenstoff im Nervensystem.
Der NO-Spiegel muss aber vom Körper durch diverse Regulationssysteme ständig gegenreguliert und in einem sehr engen Fenster gehalten werden. Denn eine übermäßige Belastung mit NO-Radikalen und seinen Folgeprodukten ist gefährlich und bringt zahlreiche körperliche Systeme aus dem Gleichgewicht. Dieser sogenannte Nitrosative Stress wurde mittlerweile von diversen Forschern als Ursache zahlreicher Krankheitsbilder identifiziert. (5 – 7)
Folgen von nitrosativem Stress
NO-Radikale sind biologisch hoch aktiv, sie können alle biologischen Membrane durchdringen und sehr schnell auf ganze körperliche Systeme einwirken. Dabei docken die NO-Radikale nicht – wie andere Botenstoffe – an Rezeptoren an, sondern binden sich im inneren der Zellen direkt an eine verschiedene Enzyme, deren Funktion auf diese Weise gehemmt wird. Außerdem verändern sie die Membranpotenziale von Zellen und Zellorganellen, wodurch bestimmte Membrankanäle geöffnet werden. Dies verursacht eine drastische Veränderung der Chemie in der Zelle – mit diversen Konsequenzen für den Zellstoffwechsel.
Durch das Überangebot von NO-Radikalen, wird vermehrt das hochreaktive Peroxinitrit gebildet, welches weitere Enzyme hemmt (8) und stark zellschädigend wirkt. (9, 10) Nitrosativer Stress kann darum gleich eine ganze Reihe von negativen Auswirkungen haben.
NO-Stress
- hemmt die Energiegewinnung in den Mitochondrien (11 – 15)
- stört wichtige Entgiftungsenzyme
- verbraucht wichtige Antioxidatien (insbesondere Melatonin, Glutathion) (16 – 18)
- stört die Hormonsynthese (19)
- stört die Neurotransmittersynthese (20)
- führt zu DNA-Schäden (21 -24)
- stört den Zellzyklus und führt zum Zelltod (25, 26)
- stört die Hämsysteme (eisenhaltige Enzyme) (27 – 29)
- stört den Cholesterin-Abbau
Alternativmedizinische Forscher wie Professor Martin Pall, Dr. med Heinrich Kremer und Dr. Bodo Kuklinski gehen heute davon aus, dass nitrosativer Stress eine der wichtigsten Größen bei der Entstehung chronischer Krankheiten ist. Bei einem Verdacht auf nitrosativen Stress sollten darum dringend entsprechende Tests durchgeführt und Gegenmaßnahmen eingeleitet werden. (siehe unten)
Nitrosativer Stress, Tryptophan und Tyrosin
Durch nitrosativen Stress und sein Folgeprodukt Peroxinitrit werden die wichtigen Aminosäuren Tryptophan und Tyrosin unwirksam gemacht. Diese spielen jedoch eine entscheidende Rolle bei der Synthese mehrerer Neurotransmitter und Hormone:
| Aminosäure | Botenstoffe |
| Tryptophan | Serotonin, Melatonin |
| Tyrosin | Dopamin, Adrenalin, Noradrenalin, Melanin |
Die Hemmung dieser Botenstoffe führt zu einer ganzen Reihe von Symptomen: Serotonin und Dopamin gelten umgangssprachlich als „Glückshormone“, weil sie großen Einfluss auf Stimmung, Motivation und psychische Stabilität haben. Serotonin und Melatonin regeln den Schlaf-Wach-Rhythmus. Gemeinsam haben die Botenstoffe großen Einfluss auf Blutdruck und das Zentralnervensystem.
NO-Stress und Schädigung der Mitochondrien
Besonders gefährdet von nitrosativem Stress sind auch die Mitochondrien – die Energiekraftwerke des Körpers. Mitochondrien verfügen über eigenes Erbgut und dieses mitochondriale Erbgut ist etwa 10-fach empfindlicher für nitrosativen Stress als Zell-DNA. Während viele Folgen von nitrosativem Stress umkehrbar sind, treten bei längerer Belastung irreversible Schäden an einigen Enzymfunktionen und am Erbgut der Mitochondrien auf, welche sogar mütterlicherseits vererbt werden können. (30)
Solche Mitochondriopathien, durch mütterlich vererbte Mutationen oder als Folge von selbst erworbenen Mutationen der Mitochondrien-DNA werden zunehmend häufiger. (31, 32) Nitrosativer und oxidativer Stress ist vermutlich eine der Hauptursachen dieser Erkrankungen.
NO-Stress: Erklärung vieler chronischer Krankheiten?
Durch die biochemischen Prozesse in Folge von NO-Stress lassen sich diverse bisher zum Teil mysteriöse Krankheiten erstmals schlüssig chemisch erklären. Dazu gehören vor allem:
- chronisches Erschöpfungs-Syndrom (Chronic Fatique Syndrome, CFS) (33, 34)
- Fibromylagie (35 – 37)
- Multiple Sklerose (38, 39)
- Rheumatoide Arthritis (40)
- Multiple chemische Sensitivität (MCS) (41)
- Post-Traumatische Stress Erkrankung (PTSD)
- Reizdarmsyndrom (42)
- Einige Formen von Morbus Parkinson (43)
- Schuppenflechte (Psoriasis), Neurodermitis (44)
- Atherosklerose (45, 46)
- Allergien (47, 48)
- Chronisch wiederkehrende Infekte
- Chronische Angst und Depression
- Chronische Schlafstörungen
Zahlreiche Therapeuten weltweit berichten von sehr guten Behandlungsergebnissen auf der Grundlage dieser Zusammenhänge und auch klinische Studien, welche dieses Postulat bestätigen, mehren sich. Trotzdem ist die Theorie des nitrosativen Stresses als Auslöser dieser Krankheiten noch Gegenstand wissenschaftlicher Debatte und hat keine allgemeine Anerkennung gefunden.
Vitamin B12 und NO-Stress
Die Theorie von Pall und Kollegen erklärt nicht nur erstmals schlüssig, wie die genannten Krankheiten entstehen, sondern auch, warum Vitamin B12 in fast allen Fällen eine gute Wirkung zeigt. Vitamin B12 ist der natürliche Gegenspieler der NO-Radikale und gleichzeitig wichtiger Teil des körpereigenen Regulationssystems für Stickstoffmonoxid: Vitamin B12 sorgt durch vielfältige Mechanismen sowohl für eine kontrollierte Bildung als auch für die Inhibition und Deaktivierung von NO. (49, 50) Vitamin B12 ist damit eine zentrale Stellschraube des Organismus, den NO-Spiegel im biologisch gewünschten Rahmen zu halten. (51, 52)
Nitrosativer Stress und Hydroxocobalamin
Neben seiner Funktion in der Regulation der NO-Bildung ist Vitamin B12 auch ein wirksamer NO-Fänger. Besonders die Vitamin-B12-Form Hydroxocoblamin bindet zuverlässig überschüssige NO-Radikale und neutralisiert sie – Cyanocobalamin, Methylcobalamin und Adenosylcobalamin hingegen zeigen weit weniger Aktivität in Bezug auf die Neutralisation von NO-Radikalen. (53, 54) Dieser Umstand dürfte eine wichtige Funktion des Hydroxocobalamin darstellen, welches etwa 50 Prozent des freien Vitamin B12 im Blut ausmacht. (55)
Neben Hydroxocobalamin reagiert vor allem reduziertes Cobalamin – eine biologische Zwischenform – mit NO-Radikalen. (56) Diese kann jedoch bisher nicht direkt medizinisch eingesetzt werden, so dass Hydroxocobalamin derzeit als der beste B12-Wirkstoff für nitrosativen Stress anzusehen ist.
Nitrosativer Stress und Vitamin-B12-Mangel
Vitamin B12, welches für die Entgiftung von NO-Radikalen eingesetzt wird, wird oxidiert und zum großen Teil ausgeschieden und steht dem Körper somit nicht mehr für Vitaminfunktionen zur Verfügung. Nitrosativer Stress kann darum auch ein Auslöser für einen Vitamin-B12-Mangel sein, denn bei einer hohen Belastung mit NO werden große Mengen Vitamin B12 verbraucht. Entsprechend sind die Vitamin-B12-Dosierungen, die bei nitrosativem Stress benötigt werden deutlicher höher als der Tagesbedarf anzusetzen. Oftmals wird darum mit Injektionen oder sehr hohen oralen Dosen gearbeitet.
Nitrosativer Stress und Peroxinitrit: der NO/ONOO–-Zyklus
Ein großer Teil der gefährlichen Wirkungen des nitrosativem Stresses geht nicht von den NO-Radikalen selbst aus, sondern von seinem Folgeprodukt Peroxinitrit. (57, 58) Peroxinitrit wird durch die Reaktion von NO mit dem Sauerstoffradikal Superoxid gebildet. Stickstoffmonoxid + Superoxid = Peroxinitrit NO + O2– = ONOO– Diese Reaktion wurde von Professor Martin Pall NO/ONOO–—Zyklus getauft, da er einen sich selbst verstärkenden, chronischen Teufelskreis darstellt: Das übermäßige Angebot von NO-Radikalen führt zu einer vermehrten Bildung von hochgiftigem Peroxinitrit. Peroxinitrit wiederum fördert die Bildung von NO-Radikalen und Superoxid, welche sich zu noch mehr Peroxinitrit verbinden. 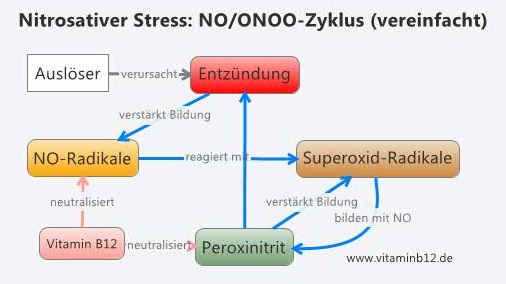 Durch Entzündungen wird die Produktion von NO und Superoxid um das Tausendfache gesteigert, welches in der Folge zu einer Steigerung der Bildung von Peroxinitrit um ein Millionfaches führt. (59)
Durch Entzündungen wird die Produktion von NO und Superoxid um das Tausendfache gesteigert, welches in der Folge zu einer Steigerung der Bildung von Peroxinitrit um ein Millionfaches führt. (59)
Wie entsteht der Teufelskreis Nitro-Stress?
Ausgelöst wird dieser Teufelskreis durch verschiedene Faktoren, die eine vermehrte körpereigene NO-Bildung verursachen.
- Virale und bakterielle Infektionen/ chronische Entzündungen
- Belastung mit Giften (Schwermetalle, Pestizide, Chemikalien)
- Medikamente (Antibiotika, Zytostatika, Statine, Langzeitnitrate, Potenzmittel)
- körperliche Traumata (insbesondere Hals-Schleudertrauma, Wirbelsäule)
- extremer psychologischer Stress
- extreme körperliche Belastung
- Sauerstoffmangel
Einmal ausgelöst, bleibt der chronische Kreislauf auch dann bestehen, wenn der ursächliche Auslöser längst beseitigt wurde. Mit herkömmlichen Therapien ist er nicht zu beseitigen, da diese meist nur medikamentös auf einzelne Symptome abzielen, was den Verlauf oftmals sogar verschlimmern kann.
Nitrat-Belastung und NO-Radikale
Der NO/ONOO-Teufelskreislauf wird noch angefeuert durch die Tatsche, dass konventionelle Lebensmittel mit großen Mengen Nitrit und Nitrat belastet sind: Dünger, Pestizide, Konservierungsmittel, Weichmacher, Farbstoffe und zahlreiche weitere chemische Zusätze liefern unnatürlich hohe Mengen von Stickstoffverbindungen. Auch über die Haut nehmen wir Stickstoffverbindungen durch Kosmetik, Färbemittel und Textilhilfsmittel auf. Und sogar über die Luft ist eine Belastung fast allgegenwärtig.
Diagnose Nitrosativer Stress
Nirtosativer Stress kann über einen einfachen Urintest festgestellt werden, dabei werden verschiedene Parameter gemessen:
| Stoff | Mechanismus | Normwert |
| Citrullin | Nebenprodukt bei der Bildung von NO-Radikalen | < 2,9 mg/g Kreatinin |
| Nitrophenylessigsäure | Folgeprodukt von NO-Stress | < 3,0 µg/g Kreatinin |
| Methylmalonsäure | Zeigt B12-Mangel in den Mitochondrien, Indiz für NO-Stress | < 2 mg/g Kreatinin |
Urintests können von Ärzten und Heilpraktikern durchgeführt werden, sind aber auch als Test-Kits für zuhause erhältlich und kosten etwa 80€ für alle drei Tests.
Therapie: Nitrosativen Stress behandeln
Nitrosativer Stress wird von Allgemeinmedizinern selten erkannt und viele Patienten mit der Aussage ihre Symptome seien „psychosomatisch“ wieder nach Hause geschickt. Oftmals entstehen dadurch jahrelange chronische Leiden, oder sogar Fehldiagnosen und -behandlungen. Dies ist um so trauriger, als dass sich nitrosativer Stress heute recht gut allein mit Nährstoffen behandeln lässt. Nachdem der Auslöser beseitigt wurde, ist es dazu nötig, den Teufelskreislauf zu durchbrechen und die in seinem Verlauf verbrauchten Nährstoffe wieder aufzufüllen. Die Therapie hat dabei drei wichtige Pfeiler:
- Behandlung des Auslösers
- Verzicht auf alle Faktoren, die den Kreislauf weiter befeuern könnten.
– konventionell angebautes Gemüse
– geräucherte Nahrungsmittel
– Tabakrauch
– Glutamat und Aspartat
– Medikamente, sofern möglich
– Stress und Überlastung (psychisch wie körperlich)
– herkömmliche Kosmetika - Durchbrechen des Kreislaufs
– Vitamin B12 hochdosiert
– Vitamin-Mix: B-Vitamine, Vitamin C, E, A und D
– Mineralien und Spurenelemente: Zink, Selen, Magnesium, Mangan, Kupfer
– Nährstoffe: Alpha-Liponsäure, Bioflavonoide, Cystein, Kurkumin, Omega-3-Fettsäuren, Q10
– Hormone/Antioxidatien: Melatonin, Glutathion
Für die Heimanwendung bietet sich eine Kombination aus Vitamin B12 (Hydroxocobalamin), Kurkumin und grünem Tee an. In schweren Fällen ist jedoch teilweise eine intravenöse Therapie nötig, um den Kreislauf effektiv durchbrechen zu können.
Fazit Nitrosativer Stress
Die neuen Erkenntnisse über nitrosativem Stress könnten einen Paradigmenwechsel in der Behandlung zahlreicher Krankheiten darstellen, die bisher medizinisch nicht zu erklären waren und als vermeintlich psychosomatische Krankheiten entweder falsch oder überhaupt nicht behandelt wurden. Die Entschlüsselung der biochemischen Mechanismen liefert erstmals eine solide theoretische Grundlage zur Erklärung und Behandlung dieser Krankheiten und auch für die vielseitigen Wirkungen des Vitamin B12 bei diesen Erkrankungen. Vitamin B12 ist in diesem Zusammenhang als natürlicher Gegenspieler der NO-Radikale ein zentrales Therapeutikum und dürfte in den nächsten Jahren darum noch weiter an Bedeutung gewinnen.
Quellen
- Beckman JS, Koppenol WH. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and ugly. Am J Physiol Cell Physiol 271: C1424–C1437, 1996.
- Squadrito GL, Pryor WA. Oxidative chemistry of nitric oxide: the roles of superoxide, peroxynitrite, and carbon dioxide. Free Radic Biol Med 1998; 25:392–403.
- Martin L. Pall. Cobalamin Used in Chronic Fatigue Syndrome Therapy Is a Nitric Oxide Scavenger. Journal of Chronic Fatigue Syndrome Vol. 8, Iss. 2, 2000
- van der Kuy PH, Merkus FW, Lohman JJ, ter Berg JW, Hooymans PM. Hydroxocobalamin, a nitric oxide scavenger, in the prophylaxis of migraine: an open, pilot study. Cephalalgia. 2002 Sep;22(7):513-9
- Pall, M. L.: Explaining „Unexplained Illnesses“: Disease Paradigm for Chronic Fatigue Syndrome, Multiple Chemical Sensitivity, Fibromyalgia, Post-Traumatic Stress Disorder, Gulf War Syndrome, and others. HPP (2007): ISBN 978-0-7890-2389-6.
- Kuklinski, B.: Nitrosativer Stress, Mitochondriopathie und Mikronährstoffe. Ärztekammer Baden-Württemberg (2006)
- Kuklinski, B.: Praxisrelevanz des nitrosativen Stresses. Umwelt Med. Gesellsch. 18. (2005) S. 95.
- Alvarez B, Radi R. Peroxynitrite reactivity with amino acids and proteins. Amino Acids. 2003 Dec;25(3-4):295-311. Epub 2003 Sep 26. Review.
- Beckman JS. Oxidative damage and tyrosine nitration from peroxynitrite. Chem Res Toxicol 9: 836–844, 1996.
- Estevez AG, Spear N, Pelluffo H, Kamaid A, Barbeito L, Beckman JS. Examining apoptosis in cultured cells after exposure to nitric oxide and peroxynitrite. In: Nitric Oxide: Biological and Antioxidant Activities, edited by Packer L. San Diego, CA: Academic, 1998, p. 393–402.
- Radi R, Cassina A, Hodara R. Nitric oxide and peroxynitrite interactions with mitochondria. Biol Chem 383: 401–409, 2002.
- Radi R, Cassina A, Hodara R. Nitric oxide and peroxynitrite interactions with mitochondria. Biol Chem 383: 401–409, 2002.
- Brookes PS, Bolanos JP, Heales SJ. The assumption that nitric oxide inhibits mitochondrial ATP synthesis is correct. FEBS Lett 446: 261–263, 1999.
- Radi R, Rodriguez M, Castro L, Telleri R. Inhibition of mitochondrial electron transport by peroxynitrite. Arch Biochem Biophys 308: 89–95, 1994.
- Cleeter MWJ, Cooper JM, Darley-Usmar VM, Moncada S, Schapira AHV. Reversible inhibition of cytochrome c oxidase, the terminal enzyme of the mitochondrial respiratory chain, by nitric oxide. FEBS Lett 345: 50–54, 1994.
- Arteel GE, Briviba K, Sies H. Protection against peroxynitrite. FEBS Lett 445: 226–230, 1999.
- Galano, A., Tan, D. X. and Reiter, R. J. (2011), Melatonin as a natural ally against oxidative stress: a physicochemical examination. Journal of Pineal Research, 51: 1–16.
- Noda Y, Mori A, Liburdy R et al. Melatonin and its precursors scavenge nitric oxide. J Pineal Res 1999; 27:159–163.
- Blanchard-Fillion B, Souza JM, Friel T, Jiang GC, Vrana K, Sharov V, Barron L, Schoneich C, Quijano C, Alvarez B, Radi R, Przedborski S, Fernando GS, Horwitz J, Ischiropoulos H. Nitration and inactivation of tyrosine hydroxylase by peroxynitrite. J Biol Chem 276: 46017–46023, 2001.
- Park S, Geddes TJ, Javitch JA, Kuhn DM. Dopamine prevents nitration of tyrosine hydroxylase by peroxynitrite and nitrogen dioxide: is nitrotyrosine formation an early step in dopamine neuronal damage? J Biol Chem 278: 28736–28742, 2003.
- Burney S, Caulfield JL, Niles JC, Wishnok JS, Tannenbaum SR. The chemistry of DNA damage from nitric oxide and peroxynitrite. Mutat Res 424: 37–49, 1999.
- Wink D, Kasprzak K, Maragos C, Elespuru R, Misra M, Dunams T, Cebula T, Koch W, Andrews A, Allen J, Keefer L. DNA deaminating ability and genotoxicity of nitric oxide and its progenitors. Science 254: 1001–1003, 1991.
- Szabó C. Poly(ADP-ribose) polymerase activation by reactive nitrogen species–relevance for the pathogenesis of inflammation. Nitric Oxide. 2006 Mar;14(2):169-79. Epub 2005 Aug 18. Review.
- Wiseman H, Halliwell B. Damage to DNA by reactive oxygen and nitrogen species: role in inflammatory disease and progression to cancer. Biochem J. 1996 Jan 1;313 ( Pt 1):17-29. Review.
- Virag L, Szabo E, Gergely P, Szabo C. Peroxynitrite-induced cytotoxicity: mechanism and opportunities for intervention. Toxicol Lett 140–141: 113–124, 2003.
- Bonfoco E, Krainc D, Ankarcrona M, Nicotera P, Lipton SA. Apoptosis and necrosis: two distinct events induced, respectively, by mild and intense insults with N-methyl-d-aspartate or nitric oxide/superoxide in cortical cell cultures. Proc Natl Acad Sci USA 92: 7162–7166, 1995.
- Boccini F, Herold S. Mechanistic studies of the oxidation of oxyhemoglobin by peroxynitrite. Biochemistry 43: 16393–16404, 2004.
- Herold S, Exner M, Boccini F. The mechanism of the peroxynitrite-mediated oxidation of myoglobin in the absence and presence of carbon dioxide. Chem Res Toxicol 16: 390–402, 2003.
- Thomson L, Trujillo M, Telleri R, Radi R. Kinetics of cytochrome c oxidation by peroxynitrite: implications for superoxide measurements in nitric oxide-producing biological systems. Arch Biochem Biophys 319: 491–497, 1995.
- Sperl, W. 23.11 Mitochondriale Erkrankungen (Mitochondriopathien)
- Sanderson S, Green A, Preece MA, Burton H (2006) The in- cidence of inherited metabolic disorders in the West Midlands. UK. Arch Dis Child 91: 896 – 9
- Schaefer AM, Taylor RW, Turnbull DM, Chinnery PF (2004) The epidemiology of mitochondrial disorders – past, present and future. Biochim Biophys Acta 1 6 5 9 : 1 1 5 – 2 0
- Pall, M. L. Elevated, sustained peroxynitrite levels as the cause of chronic fatigue syndrome. Medical hypotheses, 2000, 54. Jg., Nr. 1, S. 115-125
- Smirnova, Iva V.; PALL, Martin L. Elevated levels of protein carbonyls in sera of chronic fatigue syndrome patients. Molecular and cellular biochemistry, 2003, 248. Jg., Nr. 1-2, S. 93-95.
- Pall, Martin L. The NO/ONOO–cycle as the cause of fibromyalgia and related illnesses: etiology, explanation and effective therapy. New Research in Fibromyalgia, 2006, 2. Jg., S. 39-59.
- Ozgocmen, Salih, et al. Current concepts in the pathophysiology of fibromyalgia: the potential role of oxidative stress and nitric oxide. Rheumatology international, 2006, 26. Jg., Nr. 7, S. 585-597.
- Meeus, Mira, et al. The role of mitochondrial dysfunctions due to oxidative and nitrosative stress in the chronic pain or chronic fatigue syndromes and fibromyalgia patients: peripheral and central mechanisms as therapeutic targets?. Expert opinion on therapeutic targets, 2013, 17. Jg., Nr. 9, S. 1081-1089.
- Bo Liu, Yuefei Shen, Kaiwen Xiao, Yulan Tang, Luan Cen, and Junjie Wei. „Serum uric acid levels in patients with multiple sclerosis: a meta-analysis.“ Neurological Research 2012; 34(2), 163-171.
- Hooper DC, Spitsin S, Kean RB, Champion JM, Dickson GM, Chaudhry I, Koprowski H. Uric acid, a natural scavenger of peroxynitrite, in experimental allergic encephalomyelitis and multiple sclerosis. Proc Natl Acad Sci U S A. 1998 Jan 20;95(2):675-80.
- Migita K. Nitric oxide in rheumatoid arthritis. Nippon Rinsho 63 Suppl 1: 106–109, 2005.
- Pall, Martin L., and James D. Satterlee. „Elevated nitric oxide/peroxynitrite mechanism for the common etiology of multiple chemical sensitivity, chronic fatigue syndrome, and posttraumatic stress disorder.“ Annals of the New York Academy of Sciences 933.1 (2001): 323-329.
- Dijkstra G, Moshage H, van Dullemen HM, de Jager-Krikken A, Tiebosch AT, Kleibeuker JH, Jansen PL, van Goor H. Expression of nitric oxide synthases and formation of nitrotyrosine and reactive oxygen species in inflammatory bowel disease. J Pathol 186: 416–421, 1998.
- Zhang L, Dawson VL, Dawson TM. Role of nitric oxide in Parkinson’s disease. Pharmacol Ther 109: 33–41, 2006.
- Sikar Aktürk, A., Özdogan, H.K., Bayramgürler, D., Çekmen, M.B., Bilen, N. and Kiran, R. (2012), Nitric oxide and malondialdehyde levels in plasma and tissue of psoriasis patients. Journal of the European Academy of Dermatology and Venereology, 26: 833–837.
- Hogg N, Darley-Usmar VM, Graham A, Moncada S. Peroxynitrite and atherosclerosis. Biochem Soc Trans 21: 358–362, 1993.
- Huige Li, Sven Horke, Ulrich Förstermann, Vascular oxidative stress, nitric oxide and atherosclerosis, Atherosclerosis, Volume 237, Issue 1, November 2014, Pages 208-219, ISSN 0021-9150
- Russell P. Bowler, James D. Crapo, Oxidative stress in allergic respiratory diseases, Journal of Allergy and Clinical Immunology, Volume 110, Issue 3, September 2002, Pages 349-356, ISSN 0091-6749
- Gabr, Sami A.; Al-Ghadir, Ahmad H. Role of cellular oxidative stress and cytochrome c in the pathogenesis of psoriasis. Archives of dermatological research, 2012, 304. Jg., Nr. 6, S. 451-457.
- Carmen Wheatley. The return of the Scarlet Pimpernel: cobalamin in inflammation II — cobalamins can both selectively promote all three nitric oxide synthases (NOS), particularly iNOS and eNOS, and, as needed, selectively inhibit iNOS and nNOS. Journal of Nutritional & Environmental Medicine Volume 16, Issue 3-4, 2007
- Vijay S. Sharma et al. Reactions of Nitric Oxide with Vitamin B12 and Its Precursor, Cobinamide. Biochemistry 2003 42 (29), 8900-8908
- Carmen Wheatley, (2007) Cobalamin in inflammation III — glutathionylcobalamin and methylcobalamin/adenosylcobalamin coenzymes: the sword in the stone? How cobalamin may directly regulate the nitric oxide synthases. Journal of Nutritional & Environmental Medicine 16:3-4, pages 212-226.
- André L. F. Sampaio, Jesmond Dalli, Vincenzo Brancaleone, Fulvio D’Acquisto, Mauro Perretti, and Carmen Wheatley, “Biphasic Modulation of NOS Expression, Protein and Nitrite Products by Hydroxocobalamin Underlies Its Protective Effect in Endotoxemic Shock: Downstream Regulation of COX-2, IL-1, TNF-, IL-6, and HMGB1 Expression,” Mediators of Inflammation, vol. 2013, Article ID 741804, 20 pages, 2013.
- J. Brice Weinberg, Youwei Chen, Ning Jiang, Bethany E. Beasley, John C. Salerno, Dipak K. Ghosh, Inhibition of nitric oxide synthase by cobalamins and cobinamides, Free Radical Biology and Medicine, Volume 46, Issue 12, 15 June 2009, Pages 1626-1632, ISSN 0891-5849
- M Brouwer, W Chamulitrat, G Ferruzzi, DL Sauls, JB Weinberg. Nitric oxide interactions with cobalamins: biochemical and functional consequences. Blood Sep 1996, 88 (5) 1857-1864
- J. van Kapel, L.J.M. Spijkers, J. Lindemans, J. Abels, Improved distribution analysis of cobalamins and cobalamin analogues in human plasma in which the use of thiol-blocking agents is a prerequisite, Clinica Chimica Acta, Volume 131, Issue 3, 15 July 1983, Pages 211-224, ISSN 0009-8981
- Kruszyna, Harriet, et al. Spectroscopic studies of nitric oxide (NO) interactions with cobalamins: reaction of NO with superoxocobalamin (III) likely accounts for cobalamin reversal of the biological effects of NO. Journal of Pharmacology and Experimental Therapeutics, 1998, 285. Jg., Nr. 2, S. 665-671.
- Huie RE, Padmaja S. The reaction rate of nitric oxide with superoxide. Free Rad Res Commun 18: 195–199, 1993
- Squadrito GL, Pryor WA. The formation of peroxynitrite in vivo from nitric oxide and superoxide. Chem Biol Interact 1995; 96:203–206.
- Pál Pacher, Joseph S. Beckman, Lucas Liaudet. Nitric Oxide and Peroxynitrite in Health and Disease. Physiological Reviews Published 1 January 2007 Vol. 87 no. 1, 315-424