Wie wirkt Vitamin B12?
Vitamin B12 wirkt im Körper durch zwei bioaktive Coenzyme
- Methylcobalamin
Wirkt im Zellplasma, als Coenzym im Methylierungs-Zyklus - Adenosylcobalamin
Wirkt in den Mitochondrien, als Coenzym im Citrat-Zyklus
Aus diesen zwei Wirkmechanismen ergeben sich zahlreiche Wirkungen in diversen körperlichen Systemen, die wir in unserem Artikel Vitamin-B12-Wirkung zusammengefasst haben.
Gegenstand dieses Artikels ist die Wirkung des Methylcobalamin im Methylierungs-Zyklus.
Durch die Entscheidende Rolle des Vitamin B12 im Methylierungszyklus erklärt sich die Wirkung des Vitamin B12 auf so unterschiedliche Bereiche wie das Nervensystem, die DNA-Synthese, die Synthese von Hormonen und Neurotransmittern und die Entgiftung.
Dieser Artikel soll die genauen biochemischen Zusammenhänge dieses Wirkweges für den Laien verständlich darstellen. Ein Verständnis dieser Wirkmechanismen ist in unseren Augen wichtig, um Vitamin B12 gezielt als Nahrungsergänzung einsetzen zu können.
Wichtige Informationen in diesem Artikel
|
Methylierung – ein zentraler Baustein des Lebens
Wer sich länger mit Vitamin B12 beschäftigt, stolpert früher oder später über Begriffe wie „Methylierung“, „Methylgruppen-Geber“ oder „Methylierungs-Zyklus“. Was verbirgt sich dahinter? Und welche Rolle spielt Methylcobalamin in diesem Zusammenhang?
Methylierungsreaktionen sind ein zentraler Baustein des Lebens, sie sind wichtig für zahlreiche körperliche Prozesse. In jeder Körperzelle geschieht eine solche Methylierung Tausendfach pro Sekunde – denn ohne diese Methylierungsreaktionen wäre eine normale Zellfunktion nicht möglich.
Vitamin B12 in der Form Methylcobalamin spielt eine zentrale Rolle bei dieser Methylierung, die wir uns in diesem Artikel im Detail ansehen möchten. Zunächst seien aber die grundlegenden Begriffe geklärt.
Was ist eine Methylgruppe?
Eine Methylgruppe, auch als „Methylrest“ bezeichnet, ist eine der einfachsten Atomanordnungen in der organischen Chemie – sie besteht aus nur vier Atomen: Ein Kohlenstoff-Atom mit drei Wasserstoffatomen.
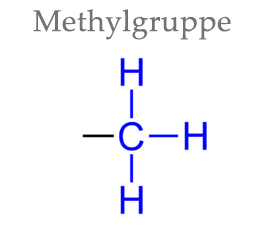
Trotz ihrer weiten Verbreitung wird die Methylgruppe nicht als eigenständige chemische Substanz betrachtet, da sie immer als Teil eines anderen Moleküls vorliegt – daher auch die Bezeichnung als „Rest“. Dennoch hat die Methylgruppe eine enorme Bedeutung für viele Abläufe im Körper und spielt eine zentrale Rolle in vielen Stoffwechselprozessen, wie wir gleich sehen werden.
Was ist Methylierung?
Stark vereinfacht könnte man sagen: Methylierung hat in vielen Zusammenhängen die Funktion eines An- oder Ausschalters. Sowohl Gene, als auch bestimmte Moleküle können durch Methylierung aktiviert oder deaktiviert werden. Methylierung ist wichtig in vielen Umwandlungs-Reaktionen im Körper und stellt so eine ganze Reihe wichtiger Substanzen bereit.
Doch was ist diese Methylierung genau? Methylierung oder genauer Transmethylierung bedeutet schlicht das Übertragen von Methylgruppen von einem Molekül auf ein anderes. Vermittelt durch bestimmte Enzyme gibt dabei das eine Molekül die Methylgruppe ab und das andere nimmt diese Methylgruppe auf. Diese einfache Reaktion sorgt oftmals dafür, dass bestimmte Substanzen aktiviert werden und eine ganze Kaskade von Stoffwechselprozessen wieder ablaufen kann.
Damit Methylierung geschehen kann, ist der Körper auf eine ganze Reihe von Enzymen angewiesen, welche den Transfer der Methylgruppen zwischen jeweils bestimmten Molekülen möglich machen. Es ist also nicht ein Enzym, das die Methylierung vermittelt, sondern die vielen Methylierungs-Reaktionen zwischen bestimmten Stoffen brauchen jeweils ein eigenes Enzym.
Was ist ein Methylgeber oder Methylgruppengeber?
Als Methylgeber oder Methylgruppen-Geber wird das dasjenige Molekül bezeichnet, welches während der Methylierungs-Reaktion die Methylgruppe abgibt.
Solche Methylgeber haben eine große Bedeutung, denn überall im Körper werden ständig Methylgruppen für die verschiedensten Prozesse gebraucht. Bestimmte Stoffe fungieren dabei im Körper als universelle Methylgeber, die dadurch eine zentrale Bedeutung im Körper haben und in zahllosen Prozessen eine Rolle spielen. Sie sorgen dafür, dass alle körperlichen Prozesse ständig mit ausreichend Methylgruppen versorgt werden. Vom Prinzip her kann man diese Stoffe gut mit ATP vergleichen – dem universellen Energiegeber des Körpers.
Der wichtigste Methylgeber des Menschen ist das S-Adenosyl-Methionin (SAM), das wir uns weiter unten noch genauer ansehen werden. [1]
SAM wird jedoch erst im Körper gebildet und erhält die dafür nötige Methylgruppe von Methylcobalamin, wodurch klar ist, dass Methylcobalamin ebenfalls ein zentraler Lieferant von Methylgruppen ist.
Ohne Vitamin B12 kann kein SAM gebildet werden: Vitamin B12 ist damit eine zentrale Schnittstelle der lebenswichtigen Methylieungs-Vorgänge.
Wozu ist Methylierung gut?
Methylierung spielt eine Rolle in vielen zentralen Prozessen, die wichtigsten sind:
Steuerung der DNA/Epigentik
Methylierung wird im Körper verwendet, um Gene an- und auszuschalten. Verändert wird dabei nicht die Information des Erbguts an sich, sondern nur, wie und ob bestimmte Gene ausgelesen werden können. Etwa 60 Prozent der menschlichen DNA sind methyliert und diese sogenannte Epigenetik hat tiefgreifenden Einfluss auf die Gesundheit. [2 – 4]Neubildung von DNA und RNA
Methylierungsfunktionen sind auch nötig, für die Reparatur und Neubildung von DNA und RNA, weil die dafür notwendigen Purine und Pyrimidine mit Hilfe des Methylierungszyklus gebildet werden. Da jede Minute Millionen von Zellen ersetzt werden müssen, ist dies eine zentrale Funktion. Fehler bei der Bildung von DNA und RNA können schwere Krankheiten nach sich ziehen. [5 – 7]Immunfunktion
Monocyten und Lymphozyten, zwei Arten von Immunzellen, müssen methyliert werden, um aktiv werden zu können. Darüber hinaus konnte gezeigt werden, dass Teile des adaptiven Immunsystems auf epigenetischen Mechanismen beruhen. [8 – 10]Synthese und Steuerung von Neurotransmittern und Hormonen
Die Synthese diverser Hormone und Neurotransmitter, darunter sämtliche Monoamin-Neurotransmitter, sind auf den Methlierungszyklus angewiesen. Gestörte Methylierung wird darum heute als ein wesentlicher Aspekt vieler psychischer Krankheiten angesehen. [11 – 13]Entgiftung
Schwermetalle werden durch Methylierung wasserlöslich und können ausgeschieden werden. Gleichzeitig ist der Methylierungs-Zyklus an der Bildung von Glutathion beteiligt, einem der wichtigsten Entgifter und Radikalfänger des Körpers. [14 – 17]Energie
Die Bildung von CoenzymQ10 und Carnitin sind auf Methylierung angewiesen. [19, 20]Protein Methylierung
Diverse zentrale Proteine sind auf Methylierung angewiesen, um gebildet zu werden, oder um bestimmte Funktionen ausführen zu können. Dies hat zum Beispiel Einfluss auf diverse Signalwege in Zellen, DNA-Reparatur, die Bildung der Nervenschutzschicht Myelin und zahlreiche andere Bereiche und berührt auf diese Weise fast alle Aspekte der Gesundheit. [21]Phospholipid Methylierung
Eine fast ebenso zentrale Rolle wie die Proteine nehmen die sogenannten Phospholipide ein. Sie sind der Hauptbestandteil der Zellmembrane und bestimmen damit wesentlich die Funktion jeder einzelnen Zelle und auch die Kommunikation der Zellen untereinander. Auch die Phospholipide sind auf Methylierung angewiesen. [22 – 24]
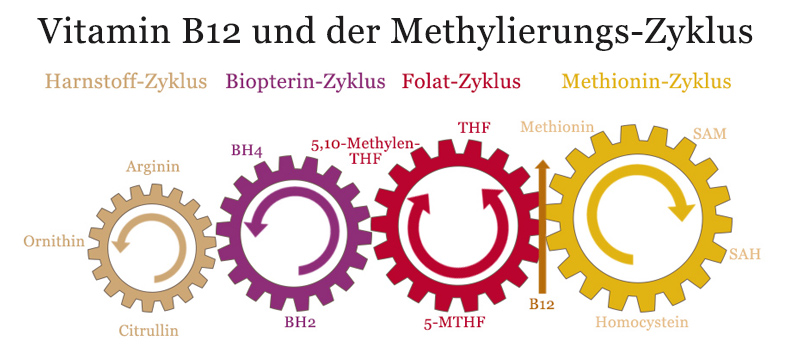
Vitamin B12 und der Methylierungs-Zyklus
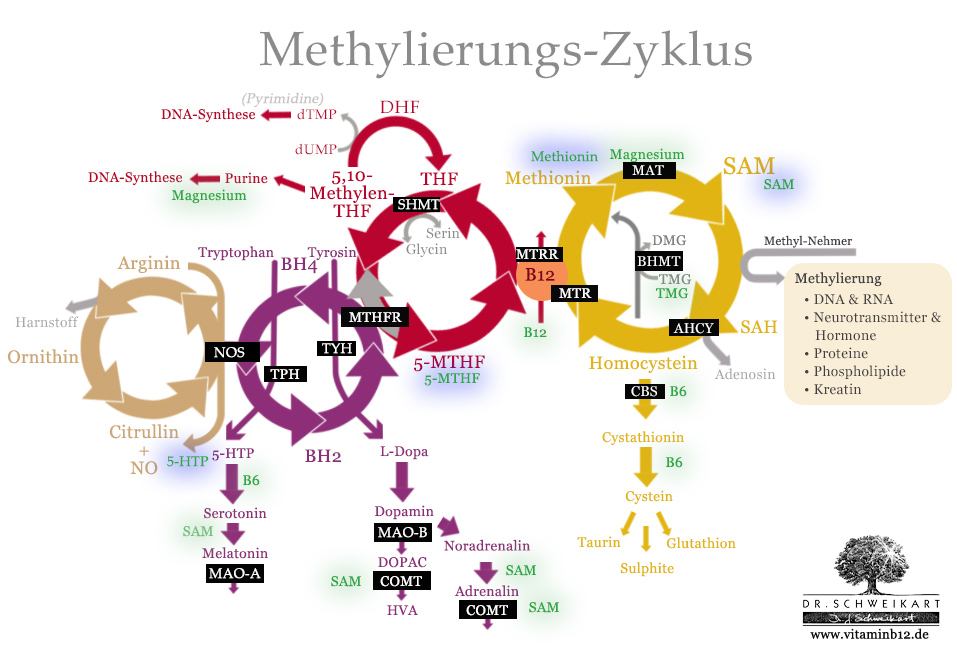
Die meisten Methylierungsprozesse im Körper sind auf S-Adenosyl-Methionin (SAM) als Methylgeber angewiesen. SAM wird dabei in einem permanenten Kreislauf immer wieder regeneriert: Es gibt in verschiedenen Reaktionen seine Methylgruppe ab, und durchläuft dann eine Reihe von Reaktionsschritten, durch die es wieder eine neue Methylgruppe erhält – und dadurch wieder als Methylgeber zur Verfügung steht. Dieser ständige Kreislauf der Regenerierung von SAM wird als Methionin-Zyklus bezeichnet.
Oftmals wird der Methionin-Zyklus auch als Methylierungs-Zyklus bezeichnet – dies ist aber nicht ganz korrekt, denn an der Methylierung sind – je nach dem wo man die Grenze zieht – insgesamt zwei bis vier verschiedene Zyklen beteiligt, die eng ineinander greifen. Erst in der Gesamtheit des Zusammenwirkens dieser Zyklen ergibt sich ein klares Bild von der Bedeutung dieser Stoffwechselvorgänge.
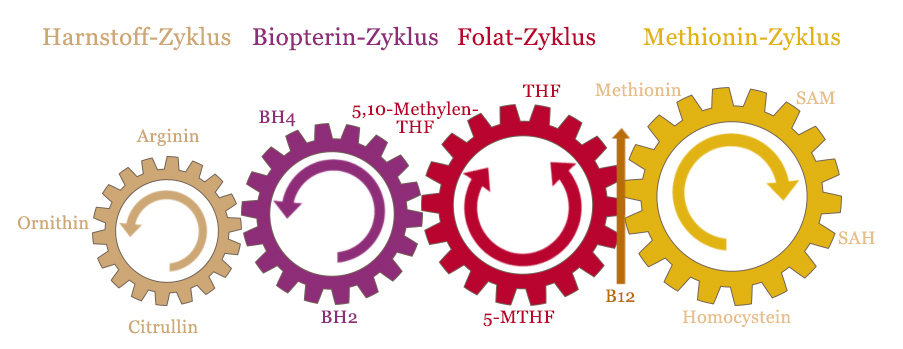
Obige Grafik stellt die vier ineinandergreifenden Zyklen dar.
Wie zu sehen, stellt Vitamin B12 dabei die Verbindungsstelle des Methionin-Zyklus mit dem Folat-Zyklus dar. Dies ist die zentrale Schnittstelle in der Regeneration des SAM aus Homocystein.
Vitamin B12 ist damit ein kritischer Faktor des Methylierungs-Zyklus – denn ohne Vitamin B12 kommt das gesamte System zum Erliegen. Eine ausreichende Zufuhr von Vitamin B12 ist darum der erste Schritt in der Optimierung der Methylierungsvorgänge.
Methylcobalamin für die Methylierung
Die im Methylierungszyklus aktive Form von Vitamin B12 heißt Methylcobalamin. Aufgrund der großen Bedeutung des Methylierungs-Zyklus für die Gesundheit ist Methylcobalamin heute die beliebteste Form von Vitamin B12.
Ein Vitamin-B12-Präparat sollte zur Optimierung der Methylierung unbedingt Methylcobalamin enthalten. Am besten jedoch in der Mischung mit dem anderen Coenzym Adenosylcobalamin, das wir in einem anderen Artikel besprechen.
Das ist wichtig
|
Dosierung B12 und Methylierung
| Wirkstoff | Dosierung | Im Internet finden |
| Methylcobalamin | 1000 µg | Methylcobalamin + B12 + Bioaktiv + 1000µg |
| Methylcobalamin + Asdenosylcobalamin | 1000 µg | Methylcobalamin + Adenosylcobalamin + Bioaktiv + 1000µg |
Vitamin B12 und Methylfolat (MTHF)
Vitamin B12 wirkt im Methylierungszyklus zusammen mit Methylfolat (5-MTHF). Bei einer Unterversorgung mit Folat kann eine Kombination der beiden Vitamine bei vielen mit dem Methylierungs-Zyklus zusammenhängenden Symptomen bemerkenswerte Besserung bringen.
Folat ist dabei nicht mit Folsäure zu verwechseln. Während alle natürlich vorkommenden Folate eine Wirkung im Körper haben, verfügt die synthetische Folsäure (chemisch: Pteroylmonoglutaminsäure) über keine eigene Vitaminfunktion. Sie muss im Körper erst umgewandelt werden, um wirksam zu werden.
Die wirksame Form von Folat wird als Methylfolat (5-MTHF) bezeichnet. Als isolierter Wirkstoff in Präparaten ist sie jedoch recht instabil, weshalb sie an natürliche Stabilisatoren wie Calcium oder Glucosamin gebunden werden muss, um eine ausreichende Bioverfügbarkeit aufzuweisen. Der Wirkstoff mit der derzeit höchsten Bioverfügbarkeit wird als Quatrefolic bezeichnet.
Das ist wichtig
|
Häufige Dosierung zur allgemeinen Ergänzung (bei kombiniertem B12- und Folsäure-Mangel)
| Nährstoffe | Dosierung | Im Internet finden |
| Vitamin B12 + Methylfolat (L-5-MTHF, Quatrefolic) | 1000µg + 400µg | Methylcobalamin + Adenosylcobalamin + 1000µg + Quatrefolic Folat 400µg |
Im Folgenden sollen nun die Teil-Zyklen der Methylierung im Einzelnen betrachtet werden, bevor wir uns ein Gesamtbild machen.
Der Methionin-Zyklus
Wie oben bereits angedeutet, ist der Methionin-Zyklus der zentrale Aspekt des Methylierungs-Zyklus und wird deshalb teilweise auch allein als Methylierungs-Zyklus bezeichnet.
Der Methionin-Zyklus ist verantwortlich für die Synthese von SAM und damit für den Großteil aller Methylierungsreaktionen im Körper. Er beeinflusst so wichtige Bereiche wie die Gesundheit der Nerven, die Methylierung von Proteinen, den Aufbau der Zellmembrane und die Aktivierung einiger Neurotransmittern.
Zeichen eines gestörten Methionin-Zyklus ist ein erhöhter Wert an Homocystein, welches heute von vielen Ärzten als wichtiger klinischer Parameter in Bluttests gemessen wird.
Der Methionin-Zyklus besteht aus 4 Substanzen:
- Methionin
- S-Adenosyl-Methionin (SAM)
- S-Adenosyl-Homocystein (SAH)
- Homocystein
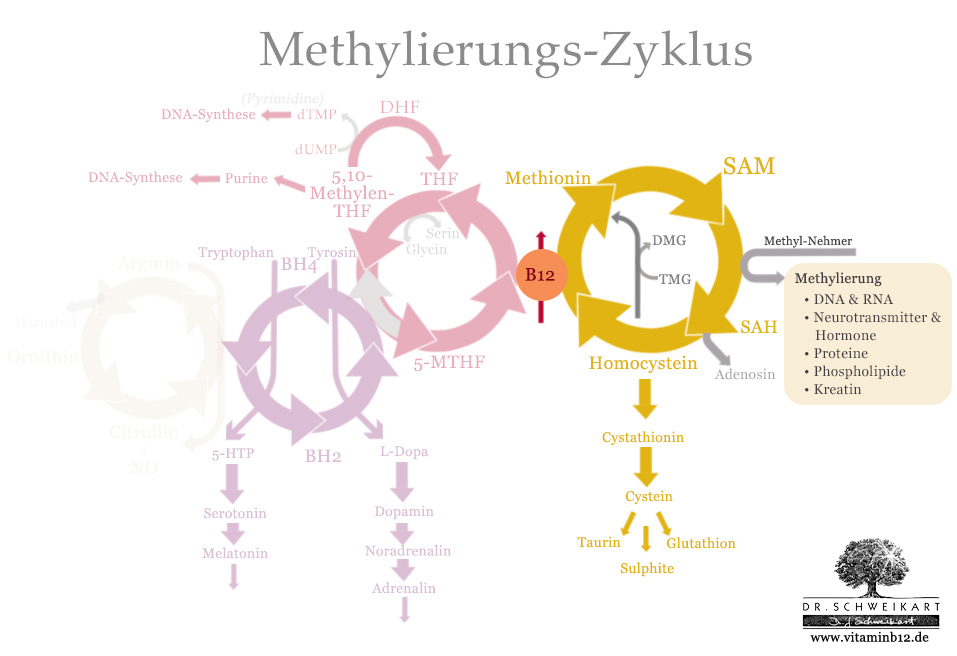
Die wesentliche Aufgabe dieses Zyklus ist es, das schädliche Homocystein abzubauen und wieder zum Methylgeber S-Adenosyl-Methionin (SAM) zu regenerieren. Wie oben bereits beschrieben, ist SAM der wichtigste universelle Methylgruppengeber des Menschen.
Der limitierende Schritt dieses Zyklus ist die Konversion von Homocystein zu Methionin durch das Enzym Methionin-Synthease (kurz MS oder MTR). Die dafür nötige Reaktion benötigt als Kofaktor Vitamin B12 in der Form Methylcobalamin. Methylcobalamin tritt dabei allerdings nur als flüchtiges Zwischenprodukt auf: Reduziertes Cobalamin (ohne Seitengruppe) nimmt dabei die Methylgruppe von 5-Methyltretrahydrofolat (5-MTHF) entgegen und reicht sie an das Homocystein weiter, wodurch Methionin entsteht.
Grundsätzlich verlässt das Vitamin B12 diese Reaktion unverändert. Im Laufe der Zeit entsteht aber immer ein gewisser Anteil inaktives Cob(II)-Cobalamin, das reaktiviert werden muss, indem es durch ein spezielles Enzym zu Methylcobalamin methyliert wird, wobei ausgerechnet SAM als Methylgeber fungiert – welches ja eigentlich mit der Hilfe Vitamin B12 gebildet werden soll. Um diesen Verlust an SAM zu verhindern, wird heute direkt Methylcobalamin zugeführt – dadurch wird das Cobalamin Recycling durch SAM überflüssig und es stehen zudem ausreichend Methylgruppen zur Verfügung.
Die Schritte des Methionin-Zyklus
Wir betrachten den Zyklus beginnend bei Methionin.
Schritt 1: Im ersten Schritt wird das Methionin in Gegenwart von Magnesium (Mg) und ATP (Universalenergiedonator) durch das Enzym Methioninadenosyltransferase (MAT) in SAM umgewandelt.
Schritt 2: SAM gibt seine Methylgruppe in diversen Reaktionen als Methylgeber ab und wird dadurch in SAH umgewandelt.
Schritt 3: SAH wiederum wird durch das Enzym S-Adenosylhomocysteinhydrogenase (SAHH) zu Homocystein umgewandelt, wobei zusätzlich Adenosin entsteht. Homocystein ist eine neurotoxische und Gefäß-schädigende Aminosäure, die heute von vielen als Zellgift betrachtet wird. Adenosin ist einerseits Teil der RNA, andererseits löst es aber auch Schläfrigkeit aus. Koffein beispielsweise entfaltet seine stimulierende Wirkung durch eine Hemmung der Adenosin-Rezeptoren. Steckt der Zyklus an dieser Stelle fest, führt dies einerseits zu einem Mangel an SAM, andererseits durch die Anstauung von Homocystein aber auch zu vielen weiteren gesundheitlichen Problemen.
Schritt 4: Nun gibt es drei Möglichkeiten, wie das Homocystein abgebaut oder zu Methionin reaktiviert werden kann.
a) Methionin-Synthease: Die erste Möglichkeit haben wir oben bereits kurz besprochen, hier wird das Homocystein wieder in Methionin umwandelt, was von Vitamin B12 und dem Folatzyklus abhängig ist. An dieser Stelle treffen sich also der Methionin- und Folatzyklus und es wird deutlich, dass sie nicht wirklich zu trennen sind.
b) Transsulfurierung: Die zweite Möglichkeit wird als Transsulfurierung bezeichnet. Hierbei wird das Homocystein durch das Enzym Cystathion-B-Synthase (CBS) und Gegenwart der Kofaktoren Vitamin B6 und Häm in Cystathion umgewandelt. Cystathion wiederum wird im nächsten Schritt in Cystein und Alphaketoglutarat umgewandelt. Dies ist der Ausgangsstoff für wichtige Substanzen wie Taurin und den zentralen Entgifter Glutathion.
c) BHMT: Die dritte Möglichkeit für diesen Schritt findet fast nur in der Leber statt. Hier wird Homocystein unabhängig von B12 und dem Folatzyklus in Methionin zurückverwandelt, wobei Trimethylglycin (TMG, auch Betain genannt = methyliertes Cholin) als Kofaktor des Enzyms Betainhomocysteinmethyltransferase (BHMT) fungiert. Die Methylgruppe kommt in diesem Fall also nicht von Methylcobalamin, sondern von TMG, dass dadurch zu Dimethylglycin (DMG) wird.
Alle diese Schritte haben eine wichtige Bedeutung, wie oben angedeutet, ist der vielleicht Entscheidende Punkt aber der Schritt über die Vitamin-B12-abhängige Methionin-Synthease – die den gesamten Methionin-Zyklus direkt an den Folat-Zyklus koppelt.
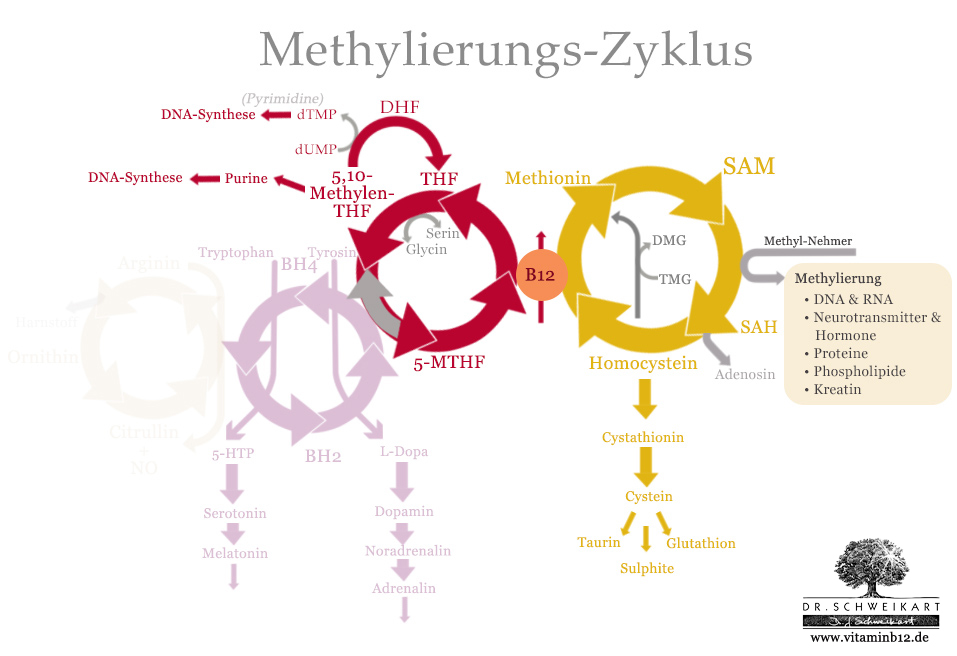
Der Folat-Zyklus
Der Folat-Zyklus besteht genau genommen aus zwei verschiedenen Zyklen. Ein großer Zyklus, der mit der Methylierung befasst ist und ein kleiner, welcher der Bildung verschiedener Stoffe dient, die eine Rolle in der Synthese von DNA spielen.
Der große Folat Zyklus
Der große Folat-Zyklus besteht aus drei Substanzen:
- Tetrahydrofolat (THF)
- 5,10-Methylentetrahydrafolat
- Methyltetrahydrofolat (MTHF)
Der Folat-Zyklus ist zuständig für Umwandlung von Tetrahydrofolat (THF) in zunächst 5,10-Methylentetrahydrafolat und schließlich 5-Methyltetrahydrofolat (MTHF). MTHF gibt seine Methylgruppe an dem Methionin-Zyklus ab, wodurch wieder THF entsteht.
Der kleine Folat-Zyklus
Ein wichtiger alternativer Kreislauf existiert von 5,10-Methylentetrahydrofolat über Dihydrofolat (DHF) zu THF. Auf diesem Wege werden wichtige Bausteine für die DNA-Synthese, die so genannten Purine und Pyrimidine hergestellt. Dieser Kreislauf sei hier aber nur der Vollständigkeit halber am Rande erwähnt, um das Thema nicht allzu komplex zu gestalten.
Die Schritte des großen Folat-Zyklus
Wir betrachten den großen Folat-Zyklus ausgehend von THF. Es ist zu beachten, das der Zyklus in der Grafik entgegen des Urzeigersinnes verläuft.
Schritt 1: THF wird mit Hilfe von Vitamin B6 und Serin in 5,10-Methylentetrahydrofolat umgewandelt. Dabei erhält THF eine „Methylengruppe“ (nicht Methylgruppe) von Serin. Alternativ zu THF kann auch die Folinsäure (5-Formyltetrahydrofolat) ebenfalls in 5,10-Methylentetrahydrofolat umgewandelt werden. Künstliche Folsäure, wie sie in vielen Nahrungsergänzungsmitteln enthalten ist, wird, kann nicht direkt verwertet werden. Es muss zunächst mit Hilfe von Vitamin B3 in DHF umgewandelt werden und dann – ebenfalls mit der Hilfe von Vitamin B3 in THF.
Schritt 2: 5,10-Methylentetrahydrofolat wird mit Hilfe von NADH, B2 und ATP durch das Enzym Methylentetrahydrafolatereduktase (MTHFR) in 5-Methyltetrahydrofolat (MTHF) umgewandelt.
Schritt 3: MTHF gibt seine Methylgruppe über Vitamin B12 an den Methionin-Zyklus ab, wodurch wieder THF entsteht und der Kreislauf von neuem beginnt.
Das MTHFR-Gen
Die kritische Stelle des Folat-Zyklus ist die Umwandlung von 5,10-Methylentetrahydrofolat zu MTHF, welches dann im Methionin-Zyklus gebraucht wird. Diese Umwandlung ist auf das Enzym MTHFR angewiesen. Viele Menschen verfügen über eine Mutation am dafür zuständigen Gen. Je nach Art der Mutation, kann die Wirksamkeit des Enzyms dabei um bis zu 70% eingeschränkt sein.
In der Folge entsteht ein Mangel an MTHF, was wiederum zu einem Mangel an SAM führt, wodurch fast sämtliche Methylierungsreaktionen des Körper beeinträchtigt werden.
Etwa 10 bis 30 Prozent der Bevölkerung verfügt über Mutationen des MTHFR-Gens und es wird zunehmend deutlicher, welche medizinische Tragweite dies haben könnte. Insbesondere, da MTHFR eine wichtige Doppelfunktion hat, wie wir gleich sehen werden.
Der Biopterin (BH4)-Zyklus
Der Biopterin-Zyklus besteht aus nur zwei Substanzen:
- Tetrahydrobiopterin (BH4)
- Dihydrobiopterin (BH2)
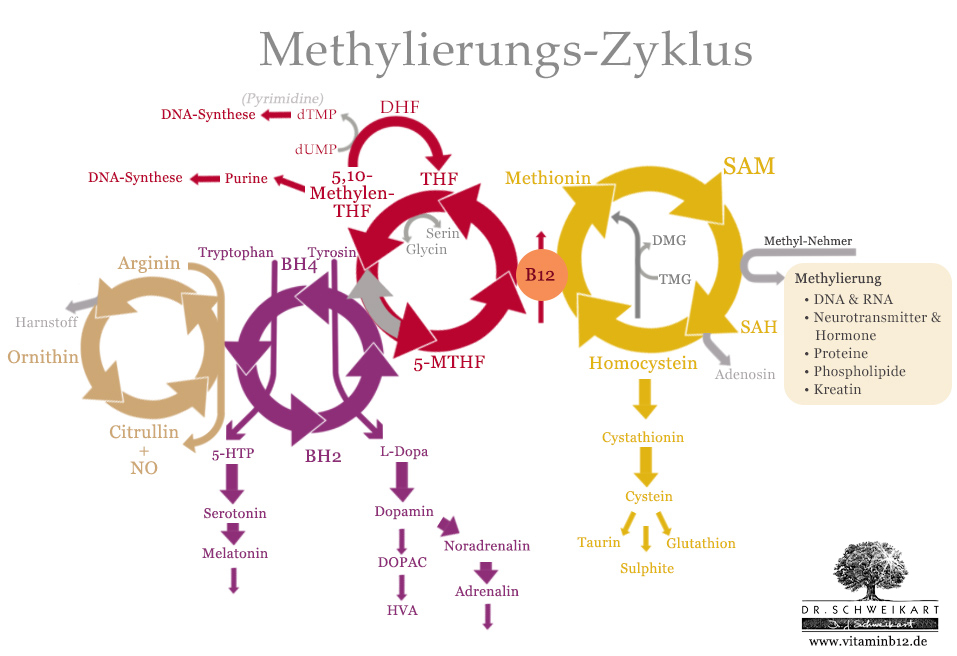
BH4 wirkt dabei als Cofaktor in diversen chemischen Reaktionen, wodurch es zu BH2 wird. Dieses wird dann, mit Hilfe von MTHF aus dem Folatzyklus wieder zu BH4 regeneriert. Hier zeigt sich nun also die bereits angekündigkte Doppelfunktion von MTHF und seinem Emzym MTHFR: MTHFR ist nicht nur wichtig für die Bildung von MTHF – und damit den Methionin-Zyklus – sondern auch für die Regenerierung von BH4.
Tetrahydrobiopterin (BH4) wiederum ist von zentraler Bedeutung für das normale Funktionieren des zentralen Nervensystems. Es ist ein wesentlicher Kofaktor für die Enzyme, die bei der Synthese von wichtigen Hormonen und Monoamin-Neurotransmittern eine Rolle spielen, insbesondere von Katecholaminen (Dopamin, Adrenalin, Noradrenalin) und Indolaminen (Serotonin und Melatonin). Der BH4-Spiegel bestimmt dabei die Produktionsrate dieser wichtigen Hormone und Neurotransmitter und damit die Fähigkeit des Körpers, Neurotransmitter wie Dopamin, Adrenalin und Serotonin zu synthetisieren.
Zudem ist BH4 wichtig für alle drei Formen von Stickoxidsyntheasen (NOS) und beeinflusst so über die NOS den angrenzenden Harnstoffzyklus, den wir hier nicht ausführlich besprechen werden.
Der Biopterin-Zyklus ist zuständig für die Synthese zweier wesentlicher Ausgangsstoffe für Hormone und Neurotransmitter:
- 5-HTP (Serotonin, Melatonin)
- L-Dopa ( Dopamin, Adrenalin, Noradrenalin)
Sehen wir uns diese im Einzelnen an.
Serotonin-Synthese
BH4 ist Kofaktor der Umwandlung von Tryptophan in 5-Hydroxytryptophan (5-HTP). 5-HTP wird durch das Enzym Hydroxytryptophan-Decarboxylase und mit der Hilfe von Vitamin B6 in Serotonin umgewandelt.
Serotonin kann dann mit Hilfe einer SAM-abhängigen Methylierungsreaktion in Melatonin umgewandelt werden – hier zeigt sich also wieder eine Quer-Verbindung zum Methionin-Zyklus. Möglicherweise erklärt diese Verbindung auch, warum Vitamin B12 sich als außerordentlich hilfreich bei Schlafstörungen erweisen hat, da Melatonin den Schlaf-Wach-Zyklus reguliert.
Dopamin-Synthese
Eine zweite Reaktion, in der BH4 als Kofaktor fungiert, ist die Umwandlung von Tyrosin in L-Dopa, welches zu Dopamin weiter verstoffwechselt wird.
Dopamin kann mit Hilfe von Vitamin C weiter zu Noradrenalin umgewandelt werden und dieses durch eine – wiederum von SAM abhängige – Methylierungs-Reaktion zu Adrenalin.
Abbau von Neurotransmittern durch MAO und COMT
SAM wird auch gebraucht, um Neurotransmitter durch die sogenannte Monoaminoxidase (MAO) und die Catechol-O-Methyltransferase (COMT) wieder abbauen zu können, was für die Signalübermittlung ebenso bedeutsam ist, wie die Synthese. Denn ein Überschuss der Neurotransmitter kann ebenso unerwünscht sein, wie ein Mangel.
Hemmer dieser Enzyme werden unter anderem zur Behandlung von psychischen Krankheiten eingesetzt, wohingegen ein Mangel ebenfalls mit verschiedenen Krankheitsbildern assoziiert ist.
Der Methlierungszyklus – ein zusammenhängendes Ganzes
Obige Darstellung ist noch immer stark vereinfacht und lässt zahlreiche weiteren Zusammenhänge unerwähnt – dennoch zeigt sie hoffentlich, wie eng vernetzt die verschiedenen Zyklen sind und welche weit reichende Bedeutung sie gemeinsam entfalten.
Sie zeigt auch, wie Unterbrechungen an einzelnen stellen – etwa durch einen Vitamin-B12-Mangel oder eine MTHFR-Mutation – das gesamte System blockieren können, wodurch sich Symptome in den verschiedensten Bereichen ergeben.
Erst das Verständnis des Methylierungszyklus ermöglicht ein tieferes Verständnis der vielen Wirkungen des Vitamin B12 auf so verschiedene Bereiche wie Nerven, DNA-Synthese und Neurotransmitter.
Über-Methylierung und Unter-Methylierung
Der aus dem Methylierungs-Zyklus resultierende Spiegel des SAM kann wohl Ursache einer Unter-Methylierung als auch einer Über-Methylierung sein.
Unter-Methylierung
Eine Unter-Methylierung entsteht dann, wenn die Synthese von SAM im Methionin-Zyklus gestört wird. Es kann dann zu wenig SAM gebildet werden und dem Körper fehlen die Methylgruppen für diverse Reaktionen: Er ist untermethyliert.
Über-Methylierung
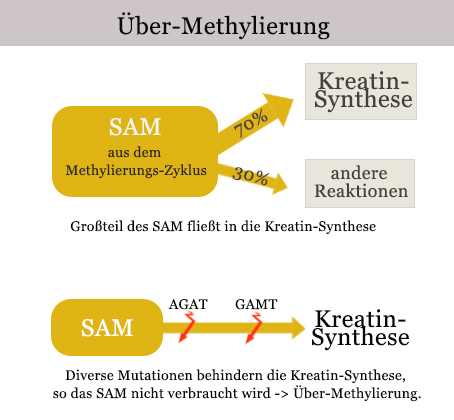
Eine Über-Methylierung entsteht, wenn zu viel SAM in Zirkulation ist. Dies kann einerseits durch falsche Nahrungsergänzung passieren, aber auch dadurch, dass das SAM nicht verwertet werden kann – zum Beispiel durch genetische Mutationen.
Etwa 70% des SAM fließen normalerweise in die Kreatin-Synthese. Kreatin ist ein wichtiger Stoff für den Aufbau und die Funktion der Muskeln. Ist die Kreatin-Synthese gestört – zum Beispiel durch Mutation der Gene AGAT oder GAMT – kann das SAM nicht verwertet werden und zirkuliert in erhöhten Spiegeln: Der Körper ist übermethyliert.
Wie kann man den Methylierungs-Status messen?
Es gibt derzeit kein absolut sicheres Verfahren, den Status der Methylierung zu messen, dennoch gibt es einige gute Marker.
Histamin (im Blut)
Für den Abbau von Histamin durch das Enzym HMNT ist der Methylgeber SAM nötig. Bei einer mangelhaften Methylierung steigt deshalb der Histaminspiegel im Blut an. Der Marker ist jedoch nicht ganz eindeutig, da HMNT nur für etwa 70% des Histaminabbaus verantwortlich ist – der Rest wird durch das Enzym DAO abgebaut. Zudem können Genmutationen an diesen Abbauenzymen das Ergebnis verfälschen. Ist das Histamin extrem hoch, besteht trotzdem starker Verdacht einer Unter-Methylierung. Ist er hingegen extrem niedrig, kann von einer guten Methylierung ausgegangen werden.
Ratio von SAM zu SAH
Nur bei wenigen Laboren und über den Arzt erhältlich sind Tests über das Verhältnis von S-Adenosyl-Methionin (SAM) zu seinem Abbauprodukt S-Adenosyl-Homocystein (SAH). Ist das Verhältnis stark in Richtung SAH verschoben, liegt eine Unter-Methylierung vor.
Homocystein
Homocystein steigt bei einer Methylierungsströung an. Ursache ist hier entweder ein Mangel an Vitamin B12 oder an Folsäure.
Vitamin B12 und Folsäure
Beide Nährstoffe haben großen Einfluss auf den Methylierungszyklus und sollten gemessen werden, wenn der Verdacht auf eine Methylierungsstörung besteht.
Unterbrechungen im Methylierungszyklus
Der Methylierungszyklus kann an diversen Stellen unterbrochen werden. Zum einen durch Nährstoff-Mängel, zum anderen aber auch durch genetische Mutationen, welche die zuständigen Enzyme beeinträchtigen.
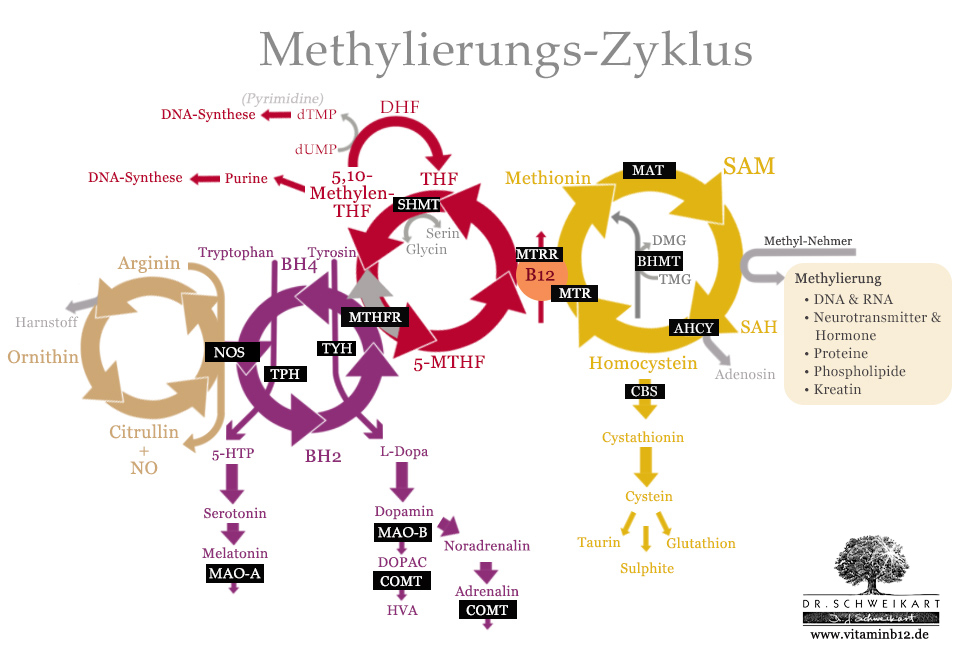
Die wichtigsten Gene und Enzyme im Methylierungs-Zyklus. (schwarz unterlegt)
Wie sinnvoll sind Gentests?
Gen-Mutationen – so genannte Single Nucleotid Polymorphisms (SNPs) – spielen eine große Rolle im Methylierungszyklus. Allerdings verfügen viele Menschen über gleich mehrere solcher Mutationen. Bei mehreren, entgegengesetzten Mutationen ist darum selbst mit einem Gentest ist schwer vorauszusagen, wie genau sich diese Mutationen in der Summe auswirken.
Eine Reihe von Mutationen fördert eine Untermethylierung, eine andere Gruppe Übermethylierung.
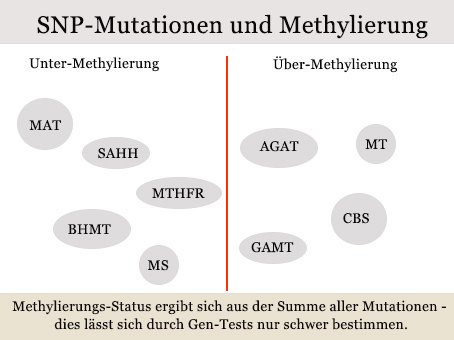
Es ist deshalb in unseren Augen sinnvoller, die Spiegel der beteiligten Nährstoffe und Metabolite zu messen.
Die wichtigsten Faktoren des Methylierungs-Zyklus
Im Rahmen dieser Darstellung soll auf drei wichtige Unterbrechungen des Methylierungszyklus eingegangen werden.
- Vitamin-B12-Mangel
- Folat-Mangel
- MTHFR-Mutation
Vitamin-B12-Mangel
Im Falle eines Vitamin-B12-Mangels kann die Methylgruppe nicht von Methylfolat an den Methionin-Zyklus übertragen werden.
In der Folge steckt der Folatzyklus am MTHF fest. MTHF staut sich an – die so genannte „Folat-Falle“. Auch der kleine Folatzyklus kann nur noch eingeschränkt ablaufen, da der Nachschub an THF aus dem großen Folat-Zyklus nicht mehr gegeben ist und das mit der Nahrung aufgenommene Folat früher oder später in der „Folat-Falle“ feststeckt“. Dies führt zu Anämie und Zellschäden.
Der Methionin-Zyklus kommt ebenfalls zum Erliegen, der Spiegel an SAM nimmt drastisch ab und das schädliche Homocystein steigt an. Betroffen davon sind alle SAM-abhängigen Reaktionen, dies betrifft zum Beispiel die Nerven, – durch verminderte Produktion von Myelin und Acetylcholin – aber auch die Neurotransmitter-Synthese und den Neurotransmitter-Abbau im Biopterin-Zyklus, wie wir oben gesehen haben.
Folat-Mangel
Im Falle eines Folat-Mangels kommt der gesamte Folat-Zyklus zum Erliegen – mit den entsprechenden Folgen für den Methionin-Zyklus und den Biopterin-Zyklus. Durch die vermittelnde Position des Folat-Zyklus in den beiden angrenzenden Zyklen, hat ein Folsäure-Mangel also weitreichende Konsequenzen: Die Produktion von SAM ist stark reduziert, die Produktion von BH4 und den damit zusammenhängenden Neurotransmittern ebenfalls.
Gleichzeitig ist auch der kleine Folat-Zyklus betroffen, was starke Auswirkungen auf die Zellteilung und die Neubildung und Reparatur von DNA hat. Dies führt zu Zellschäden und Blutarmut.
MTHFR-Mutation
Bereits angesprochen wurde die MTHFR-Mutation. Hier steckt der Folat-Zyklus bei 5,10-Methylentetrahydrafolat fest und es kann kein, oder nur wenig MTHF gebildet werden. Dies bringt wiederum sowohl den Methionin-Zyklus als auch den Biopterin-Zyklus zum Erliegen. Im Unterschied zum Folat-Mangel kann der kleine Folat-Zyklus hier jedoch fast normal ablaufen.
Beeinträchtigt ist hier vor allem die Synthese von Neurotransmittern und durch den SAM-Mangel auch diverse Methylierungsreaktionen.
Methylierung und Epigentik
Methylierung hat großen Einfluss auf die Epigenik, einem wichtigen Steuerungsmechanismus unseres Erbguts. Jede Zelle im Körper verfügt über identisches Erbmaterial. Bekannt sind etwa 20.000 Gene, welche die Information für jeweils spezifische Proteine codieren. Verschiedene Organe und Gewebe brauchen für ihre Bildung und Funktion jedoch ganz verschiedene Kombinationen diese Proteine.
Verschiedene Gewebe und Organe haben darum sogenannte epigenetische Marker im Erbgut: Sie wirken wie „Lesezeichen“, die anzeigen, welche Gene wie ausgelesen werden sollen. Diese Marker können jedoch während des Lebens verändert werden, was sowohl positive, als auch negative Auswirkungen haben kann. Heute wird davon ausgegangen, das zahlreiche Krankheiten ihre Ursachen in epigenetischen Fehlern haben könnten.
Es gibt zwei wichtige Mechanismen der Epigenetik – bei beiden spielt Methylierung eine zentrale Rolle
- DNA-Methylierung
An- und Ausschalten bestimmter Gene durch Methylierung. - Histonmodifikation
Öffnen oder Schließen bestimmter Bereiche der DNA durch Methylierung oder Acetylierung.
Methylierung und diverse Nährstoffe haben einen starken Einfluss auf die Histonmodifikation. Die DNA liegt im Zellkern in einem dicht gepackten, aufgerollten Zustand vor. Die Histone sind basische Proteine, die man sich wie Spulen vorstellen kann, um welche sich die DNA aufrollt.
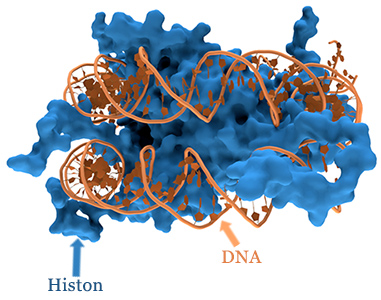
Damit ein Gen ausgelesen werden kann, muss die DNA zunächst von dieser Histon-Spule abgerollt werden. Methyl- und Acetylgruppen bestimmen, wie gut dieses gelingen kann. Methylgruppen verschließen dabei die DNA, während Acetylgruppen sie öffnen. Das Verhältnis von Acetyl- zu Methylgruppen ist bei einer Störung der Methylierung verändert, was sich direkt auf bestimmte Bereiche des Erbguts auswirken kann.
Epigenik und Methylierung: Auswirkungen für die Psyche
Insbesondere betroffen sind davon zum Beispiel die Transmembran-Proteine der Neurotransmitter, welche für die Wiederaufnahme (Deaktivierung) der Neurotransmitter zuständig sind. Sie wirken wie Schwämme, welche die Neurotransmitter von den Synapsen aufsaugen und entfernen.
Die Aktivität dieser Wiederaufnahme-Proteine hängt wesentlich von der Gen-Expression bestimmter Bereiche der DNA ab. Ob diese ausgelesen werden können, hängt von der Konzentration von Methyl- und Acetylgruppen ab. Diese wiederum ist abhängig von bestimmten Enyzmen (Acetlyasen und Methylasen), welche direkt durch verschiedene Nährstoffe, insbesondere die B-Vitamine gesteuert werden.
Vitamin | Auswirkung | Einsatz |
Niacin (Vitamin B3) | Senkt die Dopamin-Aktivität | Angststörungen, Bipolare Störungen, Schizophrenie |
SAM | Fördert die Serotonin-Aktivität (= Serotonin-Wiederaufnahme-Hemmer) | Depression |
Folat, Folsäure | Fördert die Bildung von Serotonin, Serotonin, Dopamin und Adrenalin im Methylierungszyklus, hemmt aber gleichzeitig ihre Rezeptor-Aktivität durch epigentische Mechanismen. | Hilfreich bei einigen Formen von Depression, negativ bei anderen. |
Der Methylierungzyklus in der Nährstoff-Therapie
Die Entschlüsselung des Methylierungszyklus und das Verständnis der oben genannten Blockaden hat zu zahlreichen Therapieansätzen geführt, deren Ziel es ist, die Methylierung zu optimieren und das Zusammenwirken der vier Zyklen wieder herzustellen.
Unter anderem haben diese Ansätze neue Impulse für die Nährstoffmedizin gegeben und ermöglichen durch das tiefere Verständnis der Zusammenhänge eine gezielte therapeutische Supplementation.
In jüngerer Zeit wurden nun auch diverse Mutationen entschlüsselt, welche die zentralen Enzyme des Methylierungs-Zyklus beeinflussen – die MTHFR-Mutation wurde in diesem Zusammenhang bereits besprochen. Gezielte Gen-Tests ermöglichen heute eine genaue Diagnose, wo der Methylierungszyklus unterbrochen ist und ermöglichen so auch eine gezielte Therapie mit den entsprechenden Nährstoffen.
Folsäure: Bei Depressionen ein zweischneidiges Schwert?
In der Folge wird für verschiedene Anwendung Methylfolat empfohlen. Folat zwar ist einer der zentralen Nährstoffe im Methylierungszyklus ist und ein Mangel kann schwerwiegende Auswirkungen haben – insbesondere für die Synthese wichtiger Hormone und Neurotransmitter wie das Serotonin.
Eine Therapie mit Vitamin B12 und Methylfolat bringt extrem gute Ergebnisse bei Menschen, die auf gewöhnliche Antidepressiva nicht reagieren. Der Grund ist, das diese Antidepressive als Serotonin-Wiederaufnahme-Hemmer wirken – sie verhindern, dass das Serotonin vom Körper unwirksam gemacht wird. Dies bringt keinen Erfolg bei einem Folat-Mangel, da der Körper kaum Serotonin produzieren kann. Methylfolat bringt hier rasch Besserung. [26-28]
Bei einem gewissen Prozentsatz von Patienten ist dies nicht der Fall, denn Folat wirkt auf zwei verschiedenen Wegen.
- Als Teil des Methylierungszyklus
- Als epigenetischer Faktor
Die Rolle im Methylierungszyklus wurde bereits eingehend besprochen.
In der Epigenetik hat Folat eine De-Methylierende Wirkung. [25] Es sorgt mittels des Enzyms Lysin-spezifische Demethylase (LSD-1) für eine De-Meythlierung der Histone, wodurch einige Gene verstärkt zur Expression gelangen. Dazu gehört vermutlich auch der Serotonin-Transporter SERT, welcher die Wirkung von Serotonin hemmt.
Bei einer Unter-Methylation könnte dies zu paradoxen Ergebnissen führen: Zwar steiegert Methylfolat die Bildung von Serotonin, gleichzeitig fördert es aber durch die De-Methylierung der ohnhin untermethlierten Histone die Expression von SERT und hemmt damit die Funktion des Serotonin.
Bei schlechten Ergebnissen mit Methylfolat sollten deshalb entweder Megadosen Methlfolat gegeben werden (in Studien wurden bis zu 15 mg eingesetzt), um ausreichend Methylgruppen zur Verfügung zu stellen – oder es kann direkt SAM gegeben werden.
Depression ist ein Symptom, das durch diverse Mechanismen versursacht wird. Je nach Art der Depression kann Methylfolat dramatische Verbesserungen bringen, oder aber Schwierigkeiten bereiten.
Nahrungsergänzung zur Optimierung des Methylierungszyklus
Nährstoffe können auf zwei Arten eingesetzt werden:
Optimierung des Methylierungszyklus
Hier werden Nährstoff-Mängel ausgeglichen, um eine reibungslose Funktion des Zyklus zu ermöglichenUmgehen von Unterbrechungen
Bei genetischen Mutationen, welche sich negativ auf den Methylierungszyklus auswirken, können die dadurch entstehenden Unterbrechungen auch mit Hilfe von Nährstoffen umgangen werden.
Wichtige Nährstoff-Ergänzungen für die Optimierung (grün) des Methylierungs-Zyklus und bei Gen-Mutationen (blau).
Nährstoffe für die Optimierung
Die wichtigsten Nährstoffe für die Optimierung des Methylierungszyklus sind:
- Vitamin B12 (als Hydroxo- oder Methylcobalamin)
- Methylfolat (als 5-MTHF, Quatrefolic)
- Vitamin B6 (als Pyridoxal-5-Phosphat)
- Magnesium
Nährstoffe für die Therapie
Bei genetischen Mutationen werden folgende Stoffe eingesetzt
- Methylfolat (als 5-MTHF, Quatrefolic)
Umgeht die MTHFR-Mutationen - Methionin
Umgeht Probleme mit MTHFR - SAM
Umgeht Probleme mit MTHFR und MAT - 5-HTP
Umgeht BH4-Mangel oder TPH-Mutationen
Nährstoffkombinationen bei bestimmten Symptomen
Folgende Nährstoffkombinationen sind bei bestimmten Symptomen denkbar.
| Symptom/Zweck | Nährstoffe |
| Allgemeine Ergänzung | Vitamin B12 (als Methylcobalamin oder Mischung) + Folat (Quatrefolic) |
| Depression | Vitamin B12 (Methylcobalamin oder Mischung) + Folat (Quatrefolic) + Vitamin B6 (als Pyridoxal-5-Phosphat) oder 5-HTP + SAM + Vitamin B6 + TMG (Betain) |
| Schlafstörungen | Vitamin B12 (Methylcobalamin oder Mischung) + Quatrefolic + Vitamin B6 (als Pyridoxal-5-Phosphat) |
| Erhöhtes Homocystein | Vitamin B12 (als Methylcobalamin oder Mischung) + Folat (als Quatrefolic) + Vitamin B6 (als Pyridoxal-5-Phosphat) + TMG (Betain) |
| MTHFR-Mutation | Vitamin B12 (als Methycobalamin oder Mischung) + Folat (als Quatrefolic) |
Nährstoffe für die MTHFR-Mutation
Die bei weitem häufigste genetische Mutation ist die MTHFR-Mutation. In diesen Fällen ist die Umwandlung zu 5-Methyltetrahydrofolat gestört. Eine direkte Supplementation mit 800µg 5-MTHF und 1000µg Vitamin B12 bringt hier meist gute Ergebnisse.
Eine alleinige Ergänzung mit Methylfolat ist nicht immer zielführend, da dieses eng mit Vitamin B12 zusammenwirken muss. Eine Kombination beider Vitamine bringt darum hier die besten Ergebnisse.
5-MTHF ist nur bedingt bioverfügbar, da es zum Teil im Magen zerstört wird. Es gibt aber zwei patentierte Wirkstoffe, welche das Methylfolat stabilisieren und die Bioverfügbarkeit dadurch drastisch erhöhen.
Der derzeit beste Wirkstoff ist Quatrefolic.
Stabilisator | Verfügbarkeit | |
Metafolin | Calcium | gut |
Quatrefolic | Glucosamin | Sehr gut, 20% bessere Verfügbarkeit als Metafolin |
Fazit
Gezielte Supplementation von Nährstoffen zur Optimierung der Methylierungsvorgänge hat sich in jüngerer Vergangenheit als eine spannende Therapieoption herausgestellt, die Erfolge bei verschiedensten Leiden von psychischen über neurologischen bis zu kardiovaskulären Erkrankungen zeigen konnte.
Erst näheres Verständnis der komplexen Zusammenhänge ermöglicht auch eine zielgerichtetes Vorgehen und hat zu den entsprechend besseren Ergebnissen geführt.
Wir hoffen mit dieser Darstellung einen verständlichen Einblick in die spannende Welt der Nährstoff-Medizin gegeben und auch ein besseres Verständnis der Wirkung von Vitamin B12 ermöglicht zu haben.
Quellen
- Chiang PK, Gordon RK, Tal J, Zeng GC, Doctor BP, Pardhasaradhi K, McCann PP. S-Adenosylmethionine and methylation. FASEB J. 1996 Mar;10(4):471-80. Review.
- Holliday, R. (2006). Epigenetics: a historical overview. Epigenetics, 1(2), 76-80.
- Bird, A. (1992). The essentials of DNA methylation. Cell, 70(1), 5-8.
- Jones, P. A., & Takai, D. (2001). The role of DNA methylation in mammalian epigenetics. Science, 293(5532), 1068-1070.
- Van Der Weyden, M. B., Cooper, M., & Firkin, B. G. (1973). Defective DNA Synthesis in Human Megaloblastic Bone Marrow: Effects of Hydroxy-B12 5′-Deoxyadenosyl-B12 and Methyl-B12. Blood, 41(2), 299-308.
- Metz, J., Kelly, A., Swett, V. C., Waxman, S., & Herbert, V. (1968). Deranged DNA Synthesis by Bone Marrow from Vitamin B12-Deficient Humans. British journal of haematology, 14(6), 575-592.
- Hoffbrand, A. V., & Jackson, B. F. A. (1993). Correction of the DNA synthesis defect in vitamin B12 deficiency by tetrahydrofolate: evidence in favour of the methyl-folate trap hypothesis as the cause of megaloblastic anaemia in vitamin B12 deficiency. British journal of haematology, 83(4), 643-647.
- Scharer CD, Barwick BG, Youngblood BA, Ahmed R, Boss JM. Global DNA methylation remodeling accompanies CD8 T cell effector function. J Immunol. 2013 Sep 15;191(6):3419-29.
- Yi, P., Melnyk, S., Pogribna, M., Pogribny, I. P., Hine, R. J., & James, S. J. (2000). Increase in plasma homocysteine associated with parallel increases in plasma S-adenosylhomocysteine and lymphocyte DNA hypomethylation. Journal of Biological Chemistry, 275(38), 29318-29323.
- Jacob, R. A., Gretz, D. M., Taylor, P. C., James, S. J., Pogribny, I. P., Miller, B. J., … & Swendseid, M. E. (1998). Moderate folate depletion increases plasma homocysteine and decreases lymphocyte DNA methylation in postmenopausal women. The Journal of nutrition, 128(7), 1204-1212.
- Bottiglieri, T., Laundy, M., Crellin, R., Toone, B. K., Carney, M. W., & Reynolds, E. H. (2000). Homocysteine, folate, methylation, and monoamine metabolism in depression. Journal of Neurology, Neurosurgery & Psychiatry, 69(2), 228-232.
- Miller, A. L. (2008). The methylation, neurotransmitter, and antioxidant connections between folate and depression. Alternative Medicine Review, 13(3), 216-227.
- Regland, B., Gottfries, C. G., & Oreland, L. (1991). Vitamin B12-induced reduction of platelet monoamine oxidase activity in patients with dementia and pernicious anaemia. European archives of psychiatry and clinical neuroscience, 240(4-5), 288-291.
- Ling, C. T., & Chow, B. F. (1953). The effect of vitamin B12 on the levels of soluble sulfhydryl compounds in blood. Journal of Biological Chemistry, 202, 445-456.
- Mosharov, E., Cranford, M. R., & Banerjee, R. (2000). The quantitatively important relationship between homocysteine metabolism and glutathione synthesis by the transsulfuration pathway and its regulation by redox changes. Biochemistry, 39(42), 13005-13011.
- Kikuchi, M., Kashii, S., Honda, Y., Tamura, Y., Kaneda, K., & Akaike, A. (1997). Protective effects of methylcobalamin, a vitamin B12 analog, against glutamate-induced neurotoxicity in retinal cell culture. Investigative ophthalmology & visual science, 38(5), 848-854.
- Robert A. Zakharyan, H.Vasken Aposhian, Arsenite Methylation by Methylvitamin B12and Glutathione Does Not Require an Enzyme, Toxicology and Applied Pharmacology, Volume 154, Issue 3, 1999, Pages 287-291, ISSN 0041-008X
- Ridley, W. P., Dizikes, L. J., & Wood, J. M. (1977). Biomethylation of toxic elements in the environment. Science, 197(4301), 329-332.
- Brass, E. P., & Stabler, S. P. (1988). Carnitine metabolism in the vitamin B-12-deficient rat. Biochemical journal, 255(1), 153-159.
- Quinzii, C. M., DiMauro, S., & Hirano, M. (2007). Human coenzyme Q10 deficiency. Neurochemical research, 32(4-5), 723-727.
- Kim, S., Lim, I. K., Park, G. H., & Paik, W. K. (1997). Biological methylation of myelin basic protein: enzymology and biological significance. The international journal of biochemistry & cell biology, 29(5), 743-751.
- Hirata, F., & Axelrod, J. (1980). Phospholipid methylation and biological signal transmission. Science, 209(4461), 1082-1090.
- Hirata, F. (2013). Regulation of membrane fluidity by phospholipid methylation. Membrane Fluidity in Biology: Cellular Aspects, 247.
- Vance, D. E. (2014). Phospholipid methylation in mammals: from biochemistry to physiological function. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1838(6), 1477-1487.
- Luka Z, Pakhomova S, Loukachevitch LV, Calcutt MW, Newcomer ME, Wagner C. Crystal structure of the histone lysine specific demethylase LSD1 complexed with tetrahydrofolate. Protein Sci. 2014 Jul;23(7):993-8.
- Godfrey, P. S. A., Toone, B. K., Bottiglien, T., Laundy, M., Reynolds, E. H., Carney, M. W. P., … & Chanarin, I. (1990). Enhancement of recovery from psychiatric illness by methylfolate. The Lancet, 336(8712), 392-395.
- Papakostas, G. I., Shelton, R. C., Zajecka, J. M., Etemad, B., Rickels, K., Clain, A., … & Pencina, M. (2012). L-methylfolate as adjunctive therapy for SSRI-resistant major depression: results of two randomized, double-blind, parallel-sequential trials. American Journal of Psychiatry, 169(12), 1267-1274.
- Stahl, S. M. (2007). Novel therapeutics for depression: L-methylfolate as a trimonoamine modulator and antidepressant-augmenting agent. CNS spectrums, 12(10), 739-744.